Objetivo: separar cels B, extraer RNA, hacer retrotranscripción y qPCR de cels B –> para establecer las condiciones óptimas de todo el proceso, y poder estudiar posteriormente las células B de controles tratados con IVIg o con BSA
26.04.2021: Separación cels B (control CLR)
Muestra: 3 tubos CPT (Cinta – CLR)
- Extracció de PBMCs
- Centrifugar 20 minuts a 1650 g sense fre a temperatura ambient.
- Invertir els tubs per resuspendre les cèl·lules al plasma i decantar els sobrenadants a un tub de 50 ml.
- Rentar amb suero fisiològic en una proporció 1:1 i centrifugar durant 5 minuts a 300g amb acceleració i fre.
- Treure el sobrenedant i fer un altre rentat amb suero fisiològic (posar 40 ml de suero).
- Centrifugar 5 minuts a 300 g amb acceleració i fre, i treure el sobrenedant.
- Ressuspendre el pellet en 2 ml de B cell isolation medium
- 2% de FBS: 500 µl
- 1 mM d’EDTA: 50 µl de EDTA 0’5M
- 24’5 ml de PBS
- Fer recompte cel·lular (95 ul tripan blue + 5 ul cells) : aprox 80×106 cèls/ml
- Faig 4 pellets amb 5×105 cels
- Faig 4 pellets amb 5×106 cels
- La resta: separació cels B
2. Separació de cèl·lules B
S’utilitza el kit “EasySep negative selection Human B-cell enrichment kit” (190549, Stemcell Technologies).
- Preparar la suspensió cel·lular a una concentració de 5×107 cèls/ml (en Bcell isolation medium) : les cèl·lules s’han de posar a un tub de 5 ml de polyestirene (tap de doble tancament): 2 ml
- Afegir 50 µl de Human B Cell Enrichment Cocktail cada ml de suspensió cel·lular. Barrejar bé i incubar a temperatura ambient durant 10 minuts: 100 ul
- Afegir 75 µl de D Magnetic Particles cada ml de suspensió cel·lular. Barrejar bé i incubar a temperatura ambient durant 5 minuts: 150 ul
- Afegir Bcell isolation medium fins a un volum total de 2,5 ml.
- Posar el tub (sense tap) dins de l’imant lila. Deixar 5 minuts.
- Invertir l’imant i passar el contingut del tub a un altre tub de 5 ml amb doble tancament
- Fer recompte cel·lular: 4,6 x105 cels/ml
- Faig 3 pellets amb 2,5×105 cels
- Faig 2 pellets amb 1×105 cels
- Faig 1 pellet amb 50.000 cels
Para hacer los pellets:
- Subo arriba las células en medio (en cada eppendorf)
- Centrifugo 2000g 5 minutos 4ºC
- Quito sobrenadante y lavo con PBS1x (de cultivos)
- Centrifugo 2000g 5min 4ºC
- Quito sobrenadante. Congelo a -80ºC (caja RNA cels B Cinta):
- 2 pellets PBMC 500.000 cels
- 4 pellets PBMC 5 millones cels
- 1 pellet Cels B 250.000 cels
- 1 pellet Cels B 50.000 cels
26.04.2021:Extracción RNA y RT (Cells-to-ct)
Kit: TaqMan Fast Advanced Cells-to-CT
Muestras (sin congelar previamente, pellet fresco):
- PBMC (CLR) 500.000 cels
- Cels B (CLR) 250.000 cels
- Cels B (CLR) 100.000 cels
- RNA extraction
- Add 50 µl of Lysis Solution to each sample à for each sample: 49.5 µl Lysis solution + 0.5 µl DNase I
- Mix by pipetting up and down 5 times
- Incubate for 5 minutes at room temperature
- Add 5 µl of Stop Solution to each lysis reaction
2. Reverse Transcription (RT)
- In a nuclease-free microcentrifuge tube on ice, prepare an RT Master Mix for the number of reactions required + 10% overage: for 1 reaction (total = 30 µl): preparo para 3 muestras + blanco (sin muestra, agua): todo x4,5
- 25 µl 2X Fast Advanced RT Buffer: 112,5 ul
- 2.5 µl 20X Fast Advanced RT Enzyme Mix: 11,25 ul
- 2.5 µl Nucelase-free water: 11,25 ul
- Distribute RT Master Mix to nuclease-free PCR tubes (30 µl each)
- Add 20 µl sample to each aliquot of RT Master Mix à final volume 50 µl
- Set up the thermal cycler:
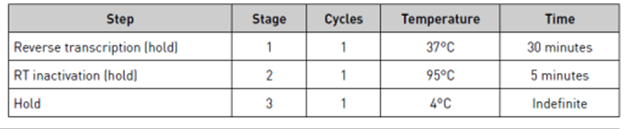
Congelo las muestras de RNA sobrantes a -80ºC (caja RNA cels B Cinta), y las muestras después de la RT a -20ºC (caja tubos pequeños)
26.04.2021: Extracción RNA (kit ThermoFisher)
Kit: PureLink RNA Mini Kit. Sigo el protocolo: Protocol for purification from animal and plant cells.
Muestras (sin congelar previamente, pellet fresco):
- PBMC (CLR) 500.000 cels
- Cels B (CLR) 250.000 cels
- Cels B (CLR) 100.000 cels
Protocolo:
- Añadir 300 ul de Lysis Buffer con B-mercaptoethanol a cada muestra (cada 1 ml de Lysis Buffer, poner 10 ul de B-mercapto).
- Vortear
- Homogeneizar células pasando el lisado por una jeringa de insulina de 5 a 10 veces
- Añadir 1.5 volúmenes de etanol 100 % (450 ul) y vortear
- Transferir todo el volumen a una Spin Cartridge (en collection tube) y centrifugar 12.000g 15s a RT
- Descartar líquido y añadir 700 ul de Wash Buffer I
- Centrifugar 12.000g 15s a RT
- Descartar líquido y poner en un nuevo collection tube
- Añadir 500 ul de Wash Buffer II
- Centrifugar 12.000g 15s a RT
- Descartar líquido y volver a repetir el último lavado (500 ul de Wash Buffer II, centrifugar 12.000g 15s a RT)
- Centrifugar 12.000g 1min a RT
- Descartar el líquido y poner la columna en un Recovery tube
- Añadir 30 ul de agua RNase-free en el centro de la columna
- Incubar 1 min a RT
- Centrifugar 12.000g 2min a RT
- Cuantificar RNA (lo hago con el nanodrop del labo):
- PBMC 500.000 cels: 3,9 ng/ul
- Cels B 250.000 cels: 1,1 ng/ul
- Cels B 100.000 cels: 4,5 ng/ul
*Volver a cuantificar pero en el Nanodrop de plataformas!!
28.04.2021: Separación cels B (control MBR)
4 tubos CPT: paciente CIDP ya tratada con IVIg el día anterior (no sirven para el estudio)
M.Mercedes Bou Rodríguez (MBR) NHC: 1362380, DN: 11/07/1964
- Extracció de PBMCs
- Centrifugar 20 minuts a 1650 g sense fre a temperatura ambient.
- Invertir els tubs per resuspendre les cèl·lules al plasma i decantar els sobrenadants a un tub de 50 ml.
- Rentar amb suero fisiològic en una proporció 1:1 i centrifugar durant 5 minuts a 300g amb acceleració i fre.
- Treure el sobrenedant i fer un altre rentat amb suero fisiològic (posar 40 ml de suero).
- Centrifugar 5 minuts a 300 g amb acceleració i fre, i treure el sobrenedant.
- Ressuspendre el pellet en 2 ml de B cell isolation medium
- 2% de FBS: 500 µl
- 1 mM d’EDTA: 50 µl de EDTA 0’5M
- 24’5 ml de PBS
- Fer recompte cel·lular (95 ul tripan blue + 5 ul cells):aprox 40 millones cels/ml
- Hago 4 pellets de 500.000 cels/pellet (1 lo uso, los otros 3 los congelo)
2. Separació de cèl·lules B
S’utilitza el kit “EasySep negative selection Human B-cell enrichment kit” (190549, Stemcell Technologies).
- Preparar la suspensió cel·lular a una concentració de 5×107 cèls/ml (en Bcell isolation medium): les cèl·lules s’han de posar a un tub de 5 ml de polyestirene (tap de doble tancament): 2 ml
- Afegir 50 µl de Human B Cell Enrichment Cocktail cada ml de suspensió cel·lular. Barrejar bé i incubar a temperatura ambient durant 10 minuts: 100 ul
- Afegir 75 µl de D Magnetic Particles cada ml de suspensió cel·lular. Barrejar bé i incubar a temperatura ambient durant 5 minuts: 150 ul
- Afegir Bcell isolation medium fins a un volum total de 2,5 ml.
- Posar el tub (sense tap) dins de l’imant lila. Deixar 5 minuts.
- Invertir l’imant i passar el contingut del tub a un altre tub de 5 ml amb doble tancament
- Fer recompte cel·lular: 170.000 cels/ml (muy pocas!!)
- Hago 2 pellets de 170.000 cels/pellet (1 lo uso, otro lo congelo)
Para hacer los pellets:
- Subo arriba las células en medio (en cada eppendorf)
- Centrifugo 2000g 5 minutos 4ºC
- Quito sobrenadante y lavo con PBS1x (de cultivos)
- Centrifugo 2000g 5min 4ºC
- Quito sobrenadante. Congelo a -80ºC (caja RNA cels B Cinta):
28.04.2021: Extracción RNA (kit RNeasy Micro Kit, Qiagen)
Kit: RNeasy Micro Kit (cat 74004, Qiagen)
Muestras:
- PBMC (MBR) 500.000 cels (sin congelar previamente, pellet fresco)
- Cels B (MBR) 170.000 cels (sin congelar previamente, pellet fresco)
- PBMC (CLR) 500.000 cels (congeladas día 26/04/21)
- Cels B (CLR) 250.000 cels (congeladas día 26/04/21)
Protocolo:
- Añadir 350 μl de Buffer RLT al pellet (máximo 500.000 cels). Vortear 1 minuto
- Añadir 350 μl de etanol 70%
- Transferir toda la muestra a una columna RneasyMinElute (nevera), encima de un collection tube. Centrifugar 8000g 15s
- Descartar el líquido y añadir 350 μl de Buffer RW1. Centrifugar 8000g 15s
- *después de este punto, si yo fuera a usar sondas de qPCR que no son m1, debería poner 10 μl de DNase I stock solution con 70 μl de Buffer RDD a la muestra, incubar a RT durante 15 min. Volver a añadir 350 μl de Buffer RW1 y centrifugar 8000g 15s
- Descartar el líquido y añadir 500 μl de Buffer RPE. Centrifugar 8000g 15s
- Descartar el líquido y añadir 500 μl de etanol 80%. Centrifugar 8000g 2 min
- Descartar el liquid y centrifugar a máxima velocidad durante 5 min (para secar la membrana)
- Descartar el líquido, poner la columna en un eppendorf, y poner 14 μl de RNAse-free water en el centro de la membrana. Centrifugar 1 min a máxima velocidad
- Cuantificar RNA (nanodrop del labo):
- PBMC (MBR): 8,8 ng/ul
- Cels B (MBR): 31,5 ng/ul
- PBMC (CLR): 9,7 ng/ul
- Cels B (CLR): 24,3 ng/ul
*Las curvas de las PBMC y cels B de CLR están mucho mejor. La próxima vez resuspender en 10 ul en vez de en 14 ul (para aumentar la concentración).
28.04.2021: RT clásica (High Capacity cDNA Reverse Transcription kit)
Muestras extraídas 28/04/21 (kit Qiagen):
- PBMC MBR
- Cels B MBR
- PBMC CLR
- Cels B CLR
Protocolo:
- Preparar el RNA a 1 ug/ 10 ul (100 ng/ul) en H2O free en un volumen final de 10 ul directamente en los microtubos de PCR à en este caso pongo directamente 10 ul de cada muestra (sin agua)
- Preparar la MIX à preparo para 4 muestras à todo x4,5
| 10X RT Buffer | 2 ul | 9 ul |
| 25X dNTP Mix (100 mM) | 0.8 ul | 3,6 ul |
| 10X RT Random Primers | 2 ul | 9 ul |
| MultiScribe Reverse Transcriptase | 1 ul | 4,5 ul |
| Nuclease-free H2O | 4.2 ul | 18,9 ul |
| Total per reaction | 10 ul |
- Vortear y añadir 10 ul a cada muestra
- Termociclador
| Setting | Step 1 | Step 2 | Step 3 | Step4 |
| Temp. (°C) | 25 | 37 | 85 | 4 |
| Time (min) | 10 | 120 | 5 | ∞ |
29.04.2021: qPCR Clásica (TaqMan™ Universal PCR Master Mix – AppliedBiosystems)
Muestras: RT 28/04/2021
- PBMC MBR
- Cels B MBR
- PBMC CLR
- Cels B CLR
Protocolo:
- Preparar MIXES de la Master Mix con cada uno de los primers según los pocillos a analizar:
MIX: n (X muestras)x3 + 2 blanco qPCR +2 extra à 4 muestras (x3) + 2 + 2 = 16 reacciones cada sonda
| Cada reacción | GAPDH (16 reac.) | |
| Master Mix 2x | 4 ul | 64 ul |
| Primers 20x | 0.4 ul | 6,4 ul |
| H2O | 3.1 ul | 49,6 ul |
- Añadir 7.5 ul de la mix a cada pocillo
- Añadir 1ul de cDNA en cada pocillo.
- Centrifugar la placa y llevar a la qPCR.
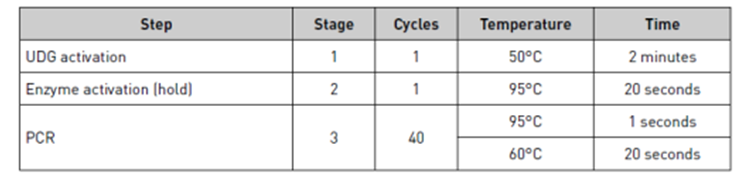
| Stage | Hold | Hold | 40 cycles | |
| Temp. (°C) | 50 | 95 | 95 | 60 |
| Time (min) | 2 | 10 | 15seg | 1 |
29.04.2021: qPCR Cells-to-ct
Kit: TaqMan Fast Advanced Cells-to-CT
Muestras: RT cell-to-ct día 26/04/21
- PBMC (CLR) 500.000 cels
- Cels B (CLR) 250.000 cels
- Cels B (CLR) 100.000 cels
Protocolo:
- Preparar la MIX para cada sonda a analizar (7 ul cada reacción):
MIX: n (X muestras)x3 + 2 blanco qPCR +2 extra: en este caso: 3 muestras (x3) + 2 pozos blanco + 2 extra = 13
| Cada reacción | GAPDH (13 reac.) | 18S (13 reac.) | |
| TaqMan Gene Expression Assay | 5 µl | 65 ul | 65 ul |
| TaqMan Assays (primers 20x) | 0.5 µl | 6,5 ul | 6,5 ul |
| Nuclease-free Water | 1.5 µl | 19,5 ul | 19,5 ul |
- Distribuir 7 ul de la MIX a cada pocillo
- Añadir 3 ul de cDNA a cada pocillo
- Centrifugar la placa y hacer qPCR
Plantillas qPCR:
http://s811335031.mialojamiento.es/lab/wp-content/uploads/2022/08/qPCR-Cell-to-Ct-29.04.21.xlsx
http://s811335031.mialojamiento.es/lab/wp-content/uploads/2022/08/qPCR-Clasica-29.04.21.xlsx
Resultados: las condiciones finales son las siguientes:
- Extracción RNA (kit RNeasy Micro Kit, Qiagen)
- RT (High-Capacity RNA-to-cDNA Kit)
- qPCR Clásica (TaqMan™ Universal PCR Master Mix – AppliedBiosystems)
